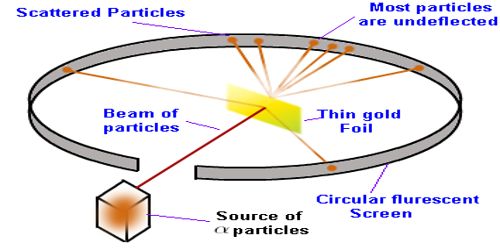
Atom adalah “sesuatu” yang berukuran sangat kecil (berdiameter kurang dari sepersejuta milimeter), karena ukurannya yang sangat kecil maka kita tidak dapat mengamatinya bahkan dengan menggunakan mikroskop. Namun, kita dapat mengetahui keberadaannya berdasarkan fenomena-fenomena yang teramati. Selain itu, melalui eksperimen hamburan Sinar-α, yang dilakukan Rhuterford yang memborbardir sebuah lempengan emas dengan sinar-α menunjukkan karakteristik dasar sebuah atom, sebagai berikut:
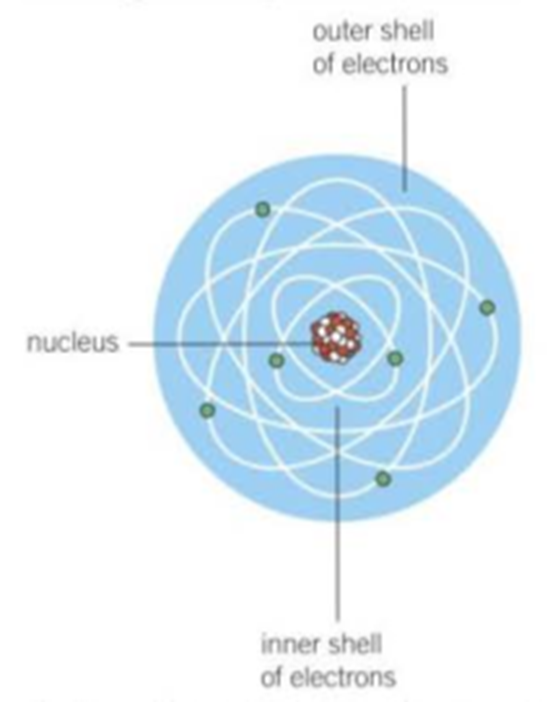
- Inti yang bermuatan positif dan tersusun dari Proton dan Neutron.
- Terdapat partikel Elektron yang mengelilingin inti.
Biasanya kita menggunakan istilah nucleus untuk proton dan neutron.
Elektron adalah partikel yang bermuatan negatif, karena inti bermuatan positif maka elektron akan terikat oleh gaya elektrostatik (Gaya Coulomb) terhadap inti. Eksperimen Rutherfords menunjukkan bahwa massa sebuah atom didominasi oleh massa inti dan diameter inti sekitar 0,00001 kali diameter dari atom.
Tabel dibawah menunjukkan karakteristik dari partikel penyusun atom.
| Partikel | Muatan (C) | Muatan relatif terhadap proton | Massa (Kg) | Massa relatif terhadap proton |
| Proton | + 1,6 x 10-19 | 1 | 1,67 x 10-27 | 1 |
| Neutron | 0 | 0 | 1,67 x 10-27 | 1 |
| Elektron | – 1,6 x 10-19 | -1 | 9,11 x 10-31 | 0,0005 |
Dari tabel diatas dapat kita lihat bahwa:
- Elektron memiliki massa yang jauh lebih kecil dibandingkan dengan proton atau neutron.
- Proton dan neutron memiliki massa yang sama, dan
- Elekton dan proton memiliki muatan yang sama (namun berlawanan). Neutron tidak bermuatan.
ISOTOP
Setiap atom dari suatu unsur memiliki jumlah proton yang sama dengan atom lain dalam unsur tersebut. Jumlah proton biasanya disebut nomor atom (disimbolkan dengan Z) dari suatu unsur. Contohnya:
- Z = 6 untuk karbon, karena setiap atom karbon memiliki 6 proton dalam intinya.
- Z = 92 untuk uranium karena uranium memiliki 92 proto dalam intinya.
Atom suatu unsur dapat memiliki jumlah neutron yang berbeda. Atom unsur yang sama yang memiliki jumlah neutron yang berbeda disebut isotop.
Sebagai contoh, isotop uranium yang jumlahnya paling melimpah terdiri dari 146 neutron dan yang paling melimpah selanjutnya terdiri dari 143 neutron.
Isotop adalah atom denan jumlah proton yang sama dan memiliki jumlah neutron yang berbeda.
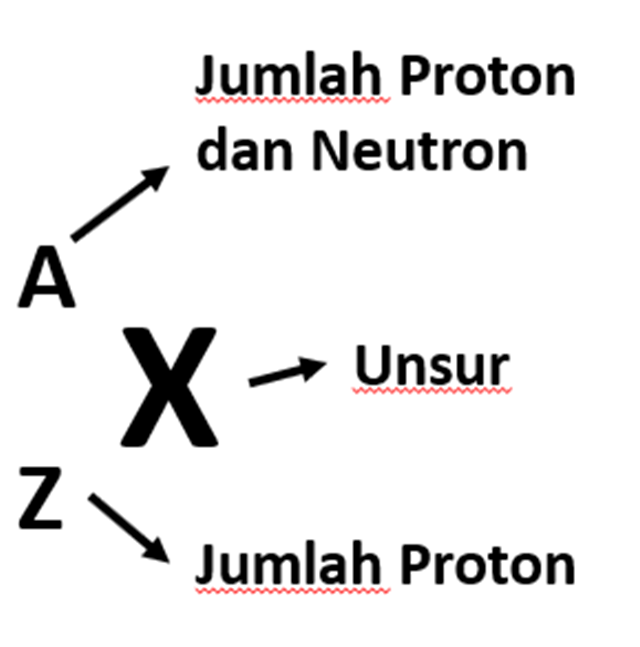
Jumlah proton dan neutron dalam sebuah atom disebut jumlah nucleon (simbol A) atau terkadang disebut nomor massa dari atom. Hal ini karena massa sebuah atom sangat diidominasi oleh massa inti.
Biasanya kita menyimbolkan isotop suatu unsur berdasarkan pada nomor atom Z, nomor massa A, dan simbol kimia dari unsur tersebut. gambar berikut menunjukkan cara penulisan suatu isotop.
Jika menurut anda artikel ini bermanfaat, silahkan untuk membagikannya, memberi komentar, dan meng klik iklannya…. Hal ini dapat menjaga eksistensi website ini. Terima kasih